Bilangan Kuantum - Kelas 10
A. Pendahuluan
Bilangan kuantum adalah suatu harga yang menyatakan keadaan orbital suatu atom. Bilangan kuantum terdiri dari:
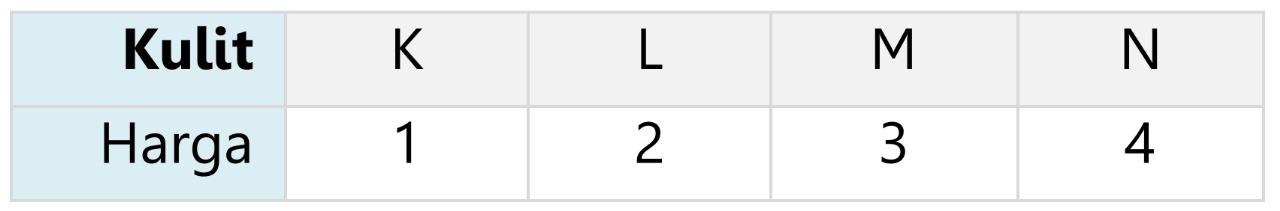
- Bilangan kuantum utama (n), menyatakan tingkat energi/kulit atom.
- Bilangan kuantum azimuth (l), menyatakan sub-kulit atom dan bentuk geometri orbital.
- Bilangan kuantum magnetik (m), yaitu menyatakan banyak dan posisi/orientasi orbital.
- Bilangan kuantum spin (s), menyatakan kedudukan elektron dalam suatu orbital.
B. Bilangan Kuantum Utama
C. Bilangan Kuantum Azimuth
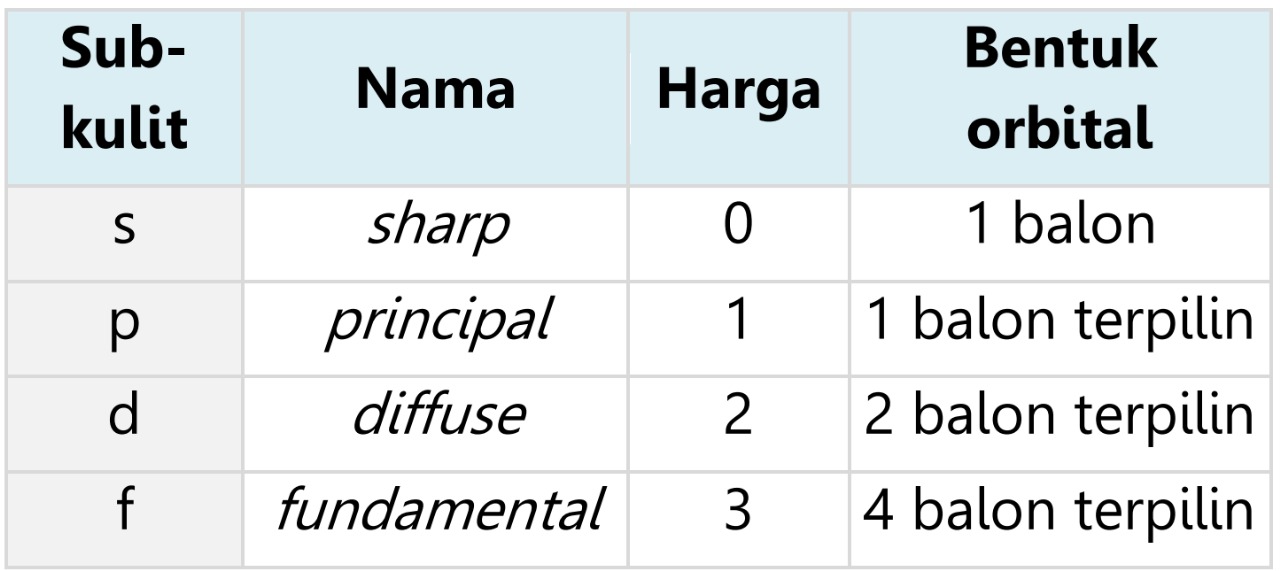
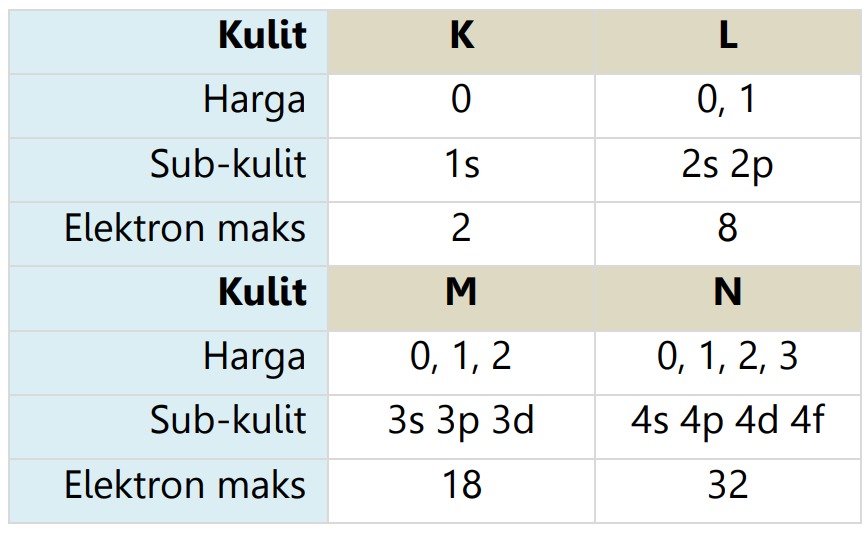
Bilangan kuantum azimuth/orbital (l) adalah suatu harga yang menyatakan sub-kulit atom dan bentuk geometri orbital. Harga l yang diijinkan di setiap kulitnya adalah:
0 ≤ l ≤ (n-1)
D. Bilangan Kuantum Magnetik
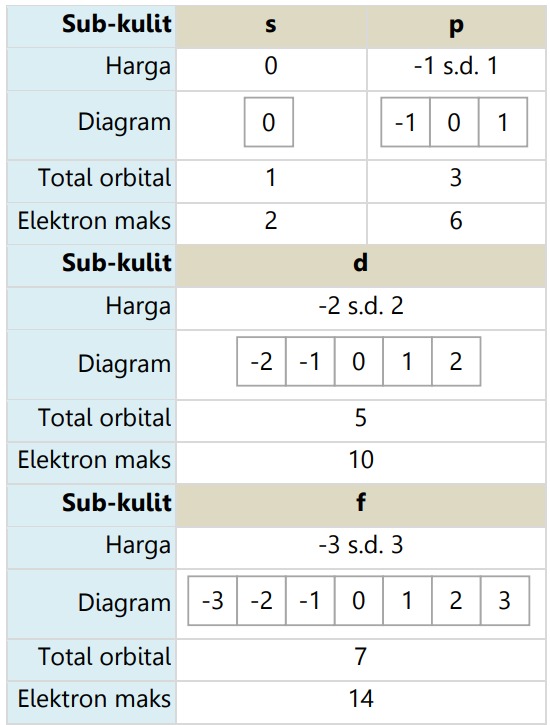
Bilangan kuantum magnetik (ml atau m) adalah suatu harga yang menyatakan banyak dan posisi/orientasi orbital. Harga m yang diijinkan di setiap sub-kulitnya:
-l ≤ m ≤ +l
E. Bilangan Kuantum Spin
Harga bilangan kuantum spin terdiri dari:
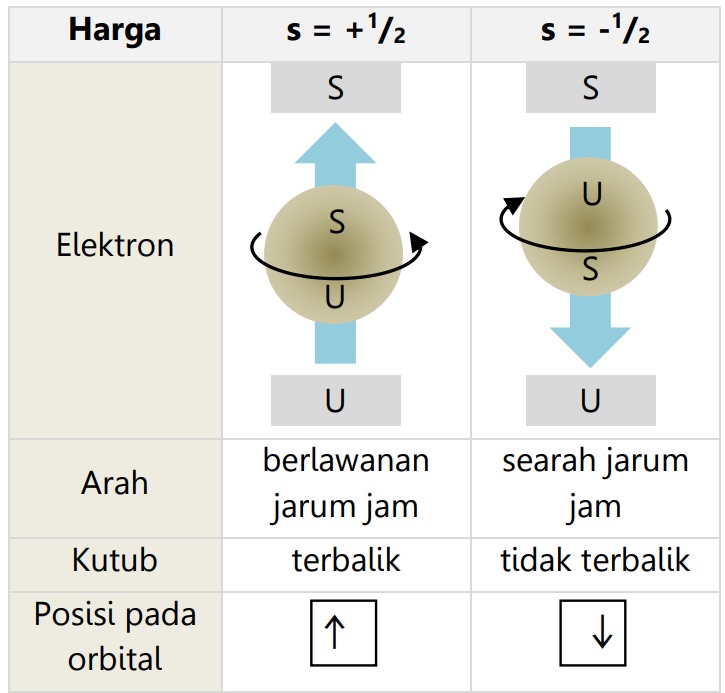
F. Bentuk Orbital
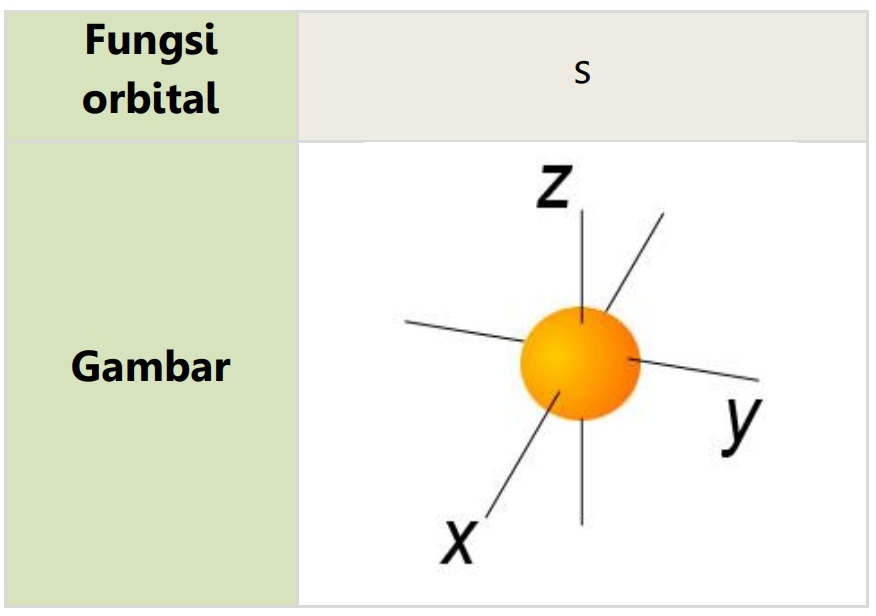
Orbital atom adalah sebuah fungsi matematika yang menggambarkan perilaku elektron pada suatu atom sebagai partikel gelombang. Orbital atom mempunyai tiga buah sumbu, yaitu sumbu x, y dan z, dan kemungkinan terbesar ditemukannya elektron terdapat pada titik pertemuannya yang disebut daerah orbital.
Orbital s berbentuk satu buah balon atau satu bola.
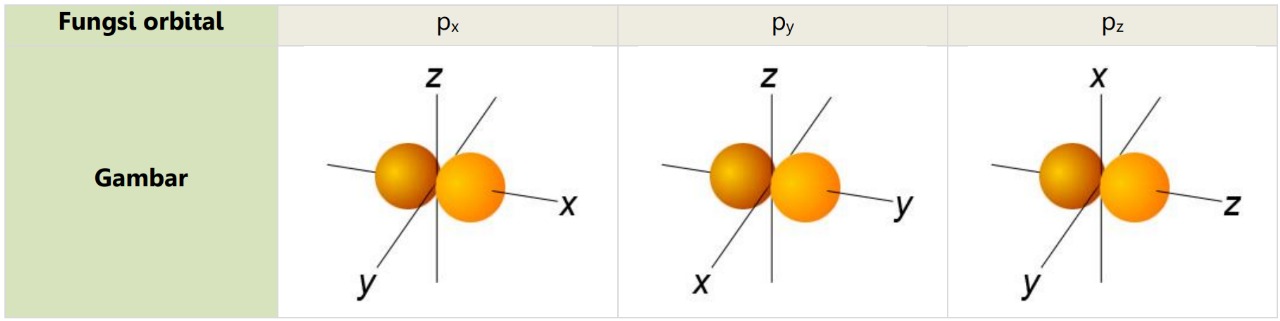
Orbital p berbentuk satu buah balon yang dipilin atau dua bola sebagai berikut.

Hibridisasi adalah gabungan orbital-orbital atom dalam suatu senyawa membentuk orbital hibrid molekul.
F. Diagram Orbital
Diagram orbital menggambarkan urutan konfigurasi elektron dalam setiap kulit atom. Konfigurasi elektron yang ditulis menggunakan bilangan kuantum harus memenuhi kaidah berikut.
1. Azas Aufbau
Pengisian elektron pada sub-kulit diisi dari tingkat energi yang lebih rendah ke tingkat energi yang lebih besar.
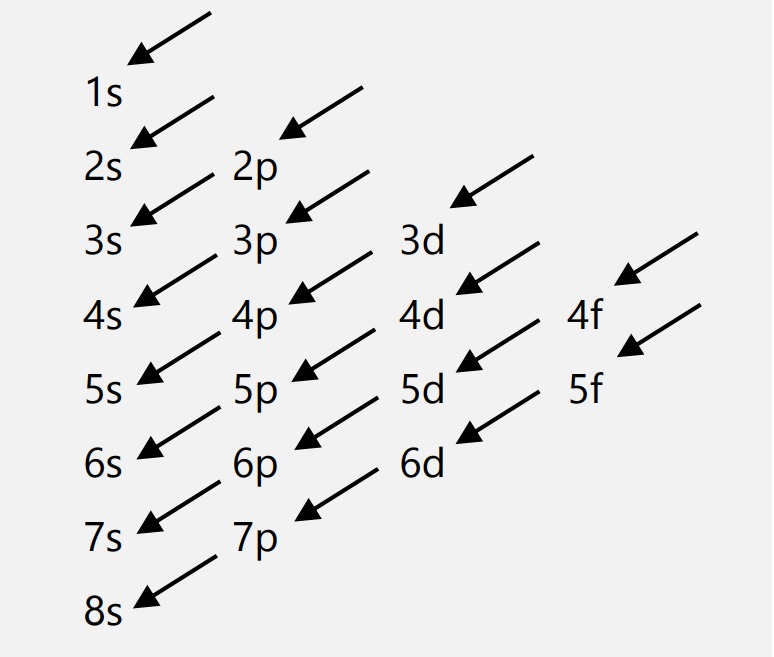
Contoh:
8O : \(1s^2 2s^2 2p^4\)
19K : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^1\)
26Fe : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^8\)
