Sifat Tabel Periodik - Kelas 10
Table of Contents
A. Pendahuluan
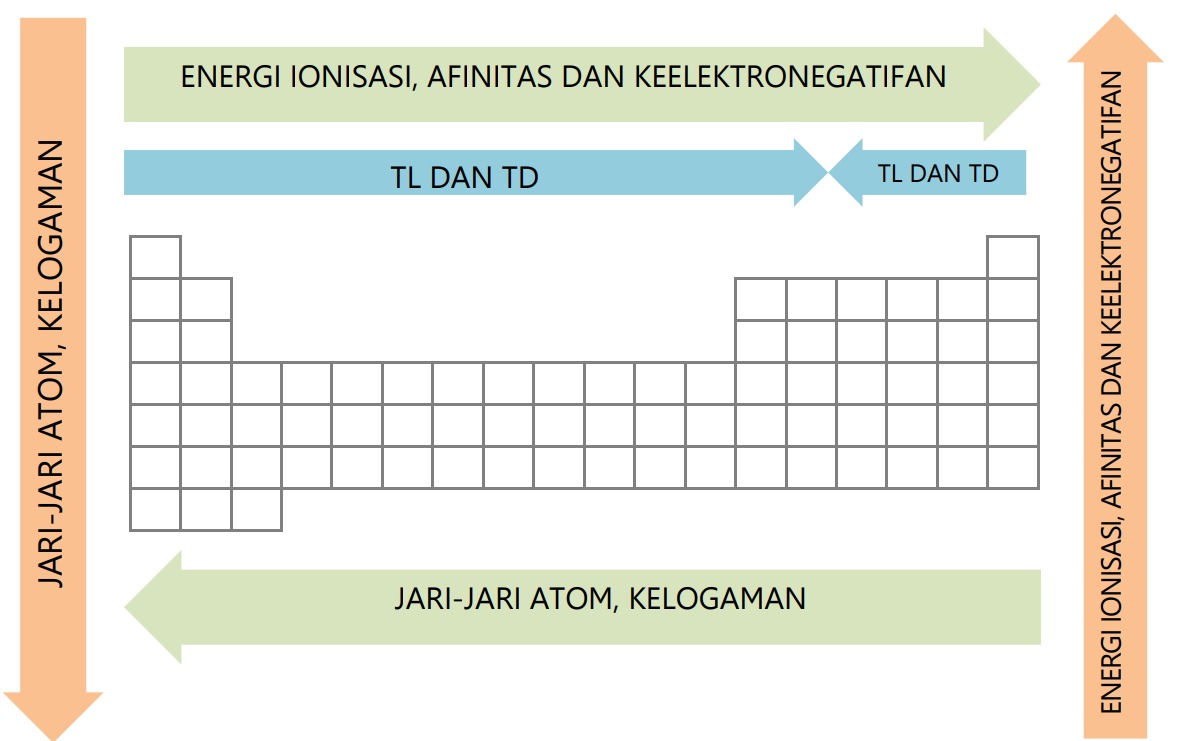
Sifat periodik adalah sifat pada tabel periodik yang berubah secara teratur sesuai kenaikan nomor atom (sistem modern), baik dalam satu golongan maupun satu periode. Sifat periodik meliputi:
- Sifat fisis, yaitu jari-jari atom, energi ionisasi, afinitas elektron, keelektronegatifan, dan kelogaman.
- Sifat kimia, yaitu titik leleh dan titik didih.
B. Jari-jari Atom
Jari-jari atom adalah jarak dari inti atom hingga kulit elektron terluar. Ukuran jari-jari atom dipengaruhi oleh:
- Jumlah kulit atom, Setiap bertambahnya jumlah kulit atom,maka bertambah pula panjang jari-jari atom.
- Muatan inti atom, Setiap bertambahnya elektron valensi atom, maka gaya tarik atau muatan inti makin besar, sehingga memperkecil jari-jari atom.
Jari-jari atom diukur dalam berbagai satuan, diantaranya dengan picometer (pm) dan amstrong (Å). Kecenderungan jari-jari dalam tabel periodik sebagai berikut.
Kecenderungan jari-jari dalam tabel periodik:
Makin ke bawah dalam satu golongan makin besar. Makin ke kanan dalam satu periode makin kecil. Jari-jari atom terbesar adalah fransium (87Fr) dan terkecil adalah helium (2He).
C. Energi Ionisasi
Energi ionisasi (EI) adalah besarnya energi yang diperlukan/diserap untuk melepas satu elektron atom netral agar menjadi ion positif. Besar EI dipengaruhi oleh jari-jari atom dan muatan inti atom.
- Bila jari-jari atom makin besar, berarti jarak elektron valensi ke inti makin jauh.
- Bila jaraknya makin jauh, maka gaya tarik/muatan inti makin kecil, sehingga elektron semakin mudah untuk ditarik.
- Semakin mudah elektron ditarik oleh inti, maka EI yang dibutuhkan kecil. EI dinyatakan menggunakan satuan kJ mol-1 atau elektronVolt (eV).
EI mengalami penyimpangan pada golongan IIA, VA, dan VIIIA, yaitu nilai EI yang sangat besar, lebih besar dari golongan di sebelah kanannya, yaitu golongan IIIA dan VIA. Penyimpangan EI terjadi karena konfigurasi elektron golongan IIA, VA, dan VIIIA yang relatif stabil.
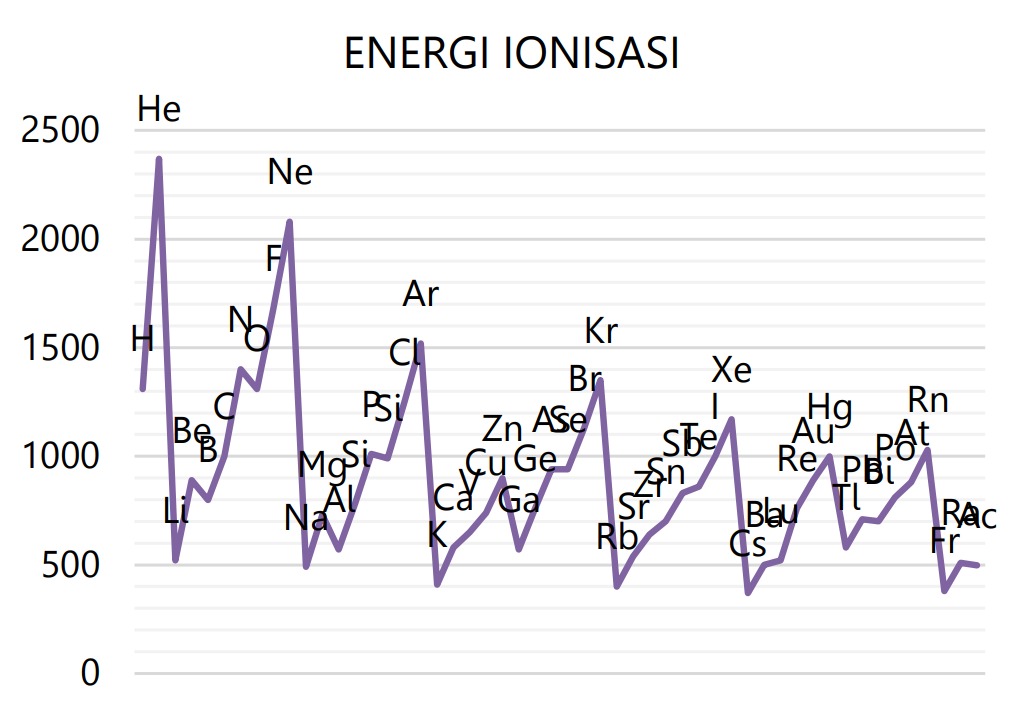
Kecenderungan EI dalam tabel periodik:
Makin ke bawah dalam satu golongan makin kecil, karena jari-jari atom makin besar dan gaya tariknya makin kecil. Makin ke kanan dalam satu periode makin besar, karena jari-jari atom makin kecil dan gaya tariknya makin besar. EI terbesar dimiliki helium (2He), dan terkecil dimiliki cesium (55Cs).
D. Afinitas Elektron
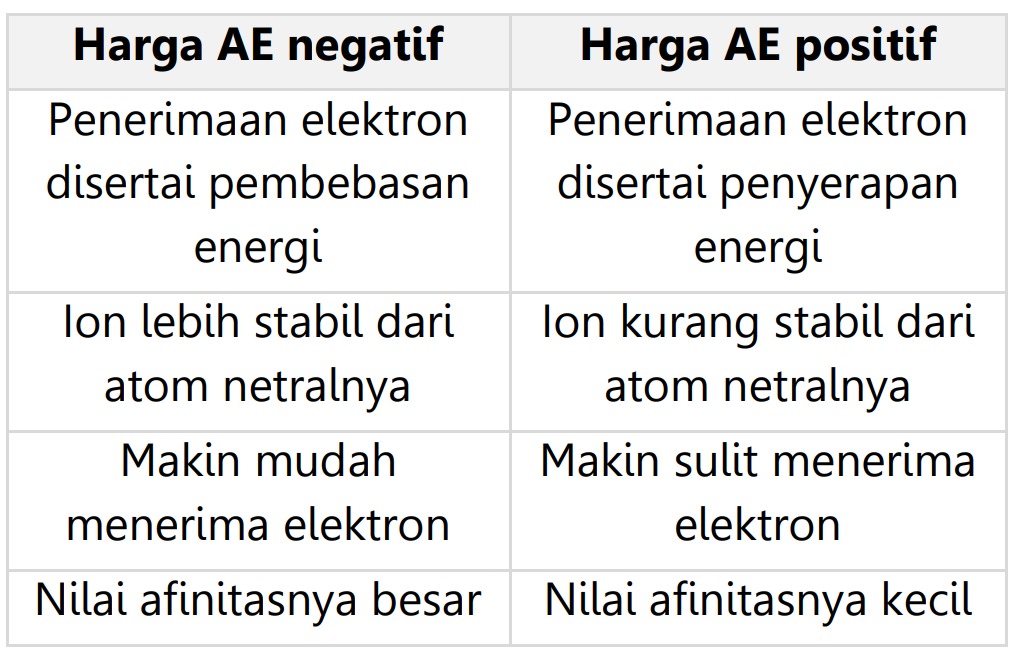
Afinitas elektron (AE) adalah besarnya energi yang dibebaskan dan diserap untuk menerima elektron dari luar atom netral agar menjadi ion negatif. Harga AE menentukan beberapa hal sebagai berikut.
AE dinyatakan menggunakan satuan kJmol-1 atau elektronVolt (eV)
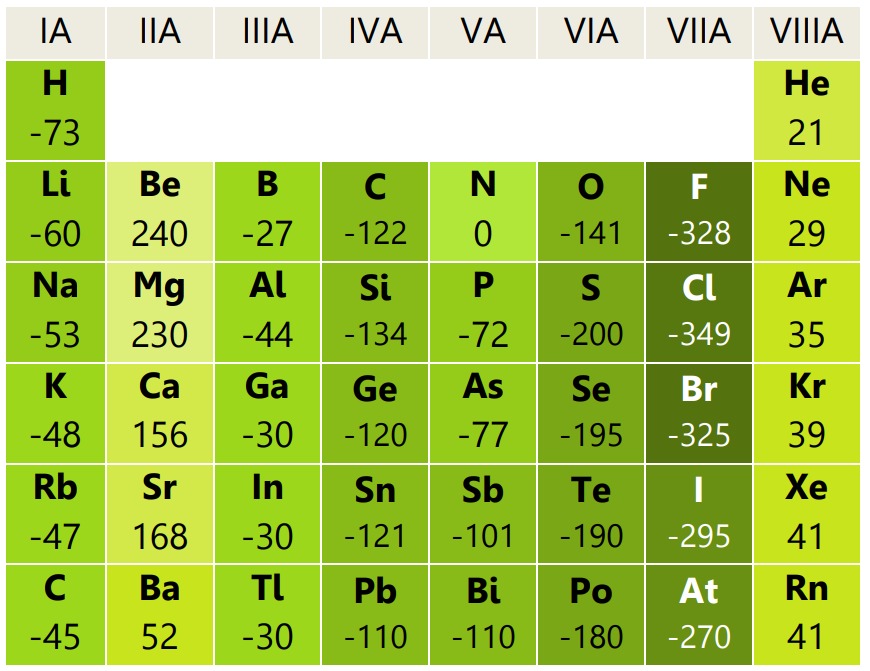
Kecenderungan AE dalam tabel periodik sebagai berikut.
Makin ke bawah dalam satu golongan makin kecil (positif), karena jari-jari atom makin besar dan gaya tariknya makin kecil. Makin ke kanan dalam satu periode makin besar (negatif), karena jari-jari atom makin kecil dan gaya tariknya makin besar.
AE terbesar dimiliki klor (17Cl), dan terkecil dimiliki berilium (4Be).
E. Keelektronegatifan
Keelektronegatifan (KE) atau elektronegativitas adalah ukuran kemampuan atau kecenderungan suatu atom untuk menarik elektron dalam ikatan kimianya. Persamaan KE dan AE adalah sama-sama membahas tentang bagaimana suatu atom menarik elektron dari luarnya. Perbedaan KE dan AE adalah, KE hanya mengukur kemampuannya saja, sedangkan AE mengaitkannya dengan jumlah energi dan pembentukan ion.
Kecenderungan KE dalam tabel periodik sebagai berikut.
Makin ke bawah dalam satu golongan makin kecil, karena jari-jari atom makin besar dan gaya tariknya makin kecil. Makin ke kanan dalam satu periode makin besar, karena jari-jari atom makin kecil dan gaya tariknya makin besar. KE terbesar dimiliki fluorin (9F), dan terkecil dimiliki fransium (87Fr).
F. Kelogaman (Keelektropositifan)
Kelogaman (KL) adalah sifat keelektro-positifan atau logam yang dimiliki unsur yang bergantung pada energi ionisasi. Logam adalah unsur yang mudah menghantarkan listrik dan melepas elektron. Garis perbatasan sifat logam dan non-logam berbentuk garis tangga. Unsur yang sifatnya perantaraan logam dan non-logam disebut metaloid.
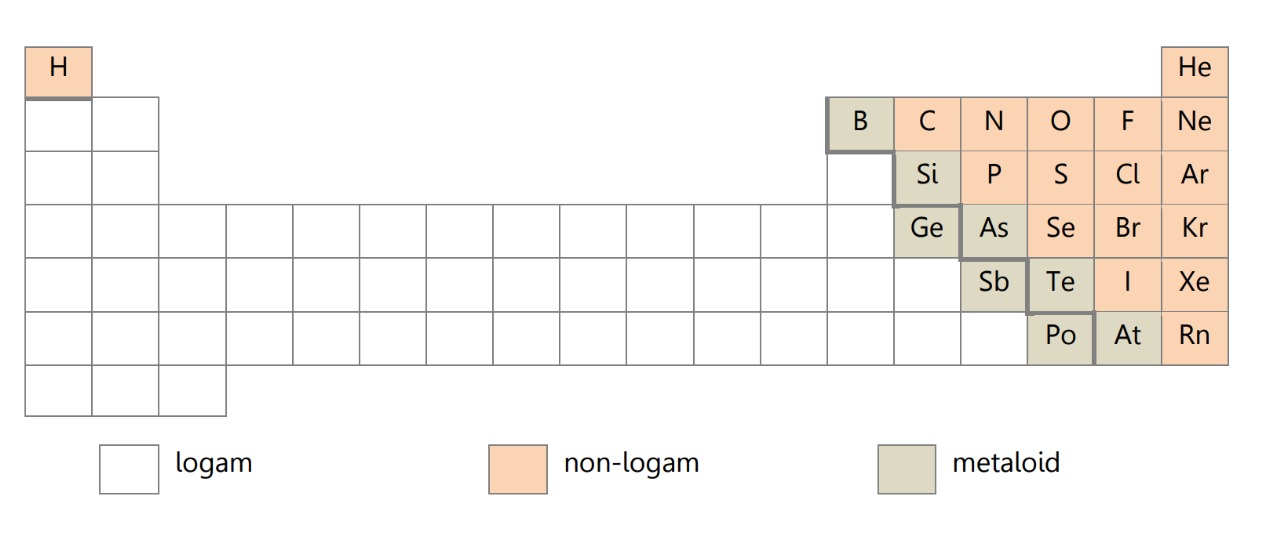
Kecenderungan sifat KL dalam tabel periodik adalah sebagai berikut.
Makin ke bawah dalam satu golongan, sifat logam makin bertambah, dan sifat nonlogam makin berkurang. Makin ke kanan dalam satu periode, sifat logam makin berkurang, dan sifat nonlogam makin bertambah.
G. Titik Didih dan Titik Leleh
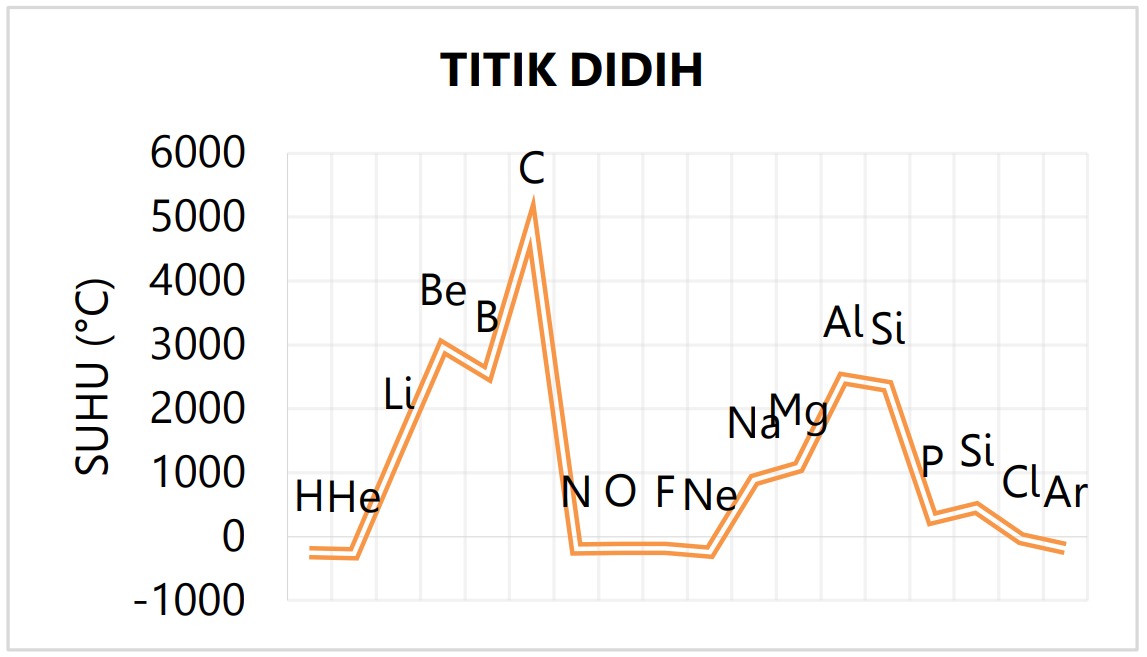
Kecenderungan sifat TL dan TD dalam tabel periodik adalah:
Golongan IA – IVA:
Makin ke bawah dalam satu golongan makin berkurang. Makin ke kanan dalam satu periode makin bertambah sampai puncaknya pada IVA (TL dan TD tertinggi).
Golongan VA – VIIIA:
Makin ke bawah dalam satu golongan makin bertambah. Makin ke kanan dalam satu periode makin berkurang.
H. Tren Periodik
Secara keseluruhan, tren /kecenderungan periodik sebagai berikut.